Введите слово или словосочетание на любом языке 👆
Язык:
Перевод и анализ слов искусственным интеллектом ChatGPT
На этой странице Вы можете получить подробный анализ слова или словосочетания, произведенный с помощью лучшей на сегодняшний день технологии искусственного интеллекта:
- как употребляется слово
- частота употребления
- используется оно чаще в устной или письменной речи
- варианты перевода слова
- примеры употребления (несколько фраз с переводом)
- этимология
Что (кто) такое Перекисные соединения - определение
Азотистые соединения; Азоторганические соединения
Перекисные соединения
класс химических соединений, содержащих непосредственно связанные между собой атомы кислорода.
Перекисные соединения неорганические. Простейший, наиболее важный и распространённый представитель этой группы - Перекись водорода H2O2. Кристаллические решётки неорганических П. с. состоят из ионов металлов и из молекулярных анионов кислорода O22-, O2- и O3-. Соответственно по наличию этих групп различают перекиси, надперекиси и озониды. Все они являются различной силы окислителями, а при слабых термических или химических воздействиях разлагаются с выделением кислорода. Наиболее просто - сжиганием на воздухе или в кислороде - получают перекиси и надперекиси щелочных металлов: Na2O2, K2O2 (перекиси), KO2, RbO2, CsO2 (надперекиси). Перекиси и надперекиси металлов - соли слабых кислот, соответственно перекиси водорода H2O2 и пергидроксила HO2. Сам пергидроксил - активная частица и при обычных температурах быстро превращается в H2O2 и O2.
Пергидроксил - промежуточная частица большинства химических процессов горения и окисления кислородом и перекисью водорода. Действием Озона (O3) на гидроокиси или надперекиси получают озониды щелочных металлов MO3 (например, KO3). Термическая нестойкость, окислительная активность, количество способного выделиться кислорода растут в ряду перекиси - надперекиси - озониды. Гидролиз этих П. с. происходит с образованием различных по силе окислителей (насыщенных соединений, как H2O2, или частиц, как OH):
M2O2 + 2H2O = 2MOH + H2O2,
M2O2 + H2O = MOH + HO2,
MO3 + H2O = MOH + HO + O2.
К этим группам соединений примыкают пероксигидраты - соединения, содержащие вместо кристаллизационной воды кристаллизационную H2O2, например K2CO3.3H2O2, в том числе и пероксигидраты перекисей, например CaO2.2H2O2.
Пероксогруппа - O - O - входит в состав пероксо- или надкислот и двуядерных комплексных соединений. Примером служат пероксосерные кислоты - пероксомоно- и пероксодисерная,
HOSO2 - ООН
и
HOSO2 - O - O - SO2OH.
Аналогичные пероксопроизводные известны для угольной и некоторых других кислот. Эти соединения получают либо путём электролиза обычных кислот, либо при взаимодействии концентрированных кислот и H2O2. Двуядерные комплексы, содержащие пероксогруппу, известны для ряда металлов, а наиболее изучены для комплексов кобальта; многие из них могут быть получены при взаимодействии кислорода с солями кобальта (в растворе или в кристаллическом состоянии). Большинство пероксосоединений водой гидролизуется с образованием H2O2.
П. с. нашли применение в технике как окислители (пероксодисерная кислота, Перекись натрия), отбеливатели (пероксобораты, например NaBO3; пероксокар-бонаты, например Na2CO3), как удобные источники кислорода для регенерации воздуха - эквивалентного превращения CO2 в O2 (надперекиси NaO2, KO2). Некоторые комплексные пероксосоли обратимо присоединяют, а при нагревании или изменении кислотности раствора выделяют кислород. На этом основано их применение как "кислородных батарей", как переносчиков кислорода, для разделения азотно-кислородных смесей. Различие в строении неорганических П. с. обусловливает различие их физических свойств и реакционной способности и возможность применения в разнообразных условиях.
А. П. Пурмаль.
Перекисные соединения органические содержат группировку - О - О -, связанную с одним или двумя атомами углерода. Основные типы органических П. с.: 1) перекиси алкилов и арилов R - O - O - R (здесь и далее R - алкил или арил); 2) перекиси ацилов RCO-O-O-COR; 3) гидроперекиси R - O - O - Н; 4) перкислоты (надкислоты) RCO - O - O - H. К ним примыкают соединения, в которых перекисная группировка связана с гетероатомом, например R3Si - O - O - Li, R2B - O - OR, и озониды, содержащие группировки - О - О - О -, например CF3 - O - O - O - CF3.
П. с. получают главным образом окислением различных органических соединений (например, насыщенных углеводородов, олефинов, спиртов, альдегидов, кетонов, металлоорганических соединений) кислородом (часто - фотохимически) или перекисью водорода, например:
Перекиси ацилов и надкислоты получаются взаимодействием карбоновых кислот или их производных с перекисью водорода в присутствии оснований:
Перекись диметила CH3OOCH3 - газ, tкип - 13 °С; перекись ди-трет-бутила - tкип 70 °С (при 197 мм рт. ст.); перекись ацетила (CH3COO)2 - tпл 27 °С, tкип 63 °С (при 21 мм рт. ст.), перекись бензоила (C6H5COO)2 - tпл 106-108 °С; надбензойная кислота C6H5CO - O - O - H - tпл 41-43 °C. Известны полимерные П. с. типа
.
При нагревании или облучении ультрафиолетовым светом органических П. с. происходит разрыв кислород-кислородной связи с образованием свободных радикалов типа RO․ или RCO - O․, дальнейшая судьба которых (а следовательно, и общее направление реакции) зависит от характера R. Алкоксильные или ацилоксильные радикалы чаще всего распадаются дальше, давая свободные углеводородные радикалы, например:
Образующиеся свободные радикалы могут вызвать цепной распад П. с., поэтому многие из них, особенно низшие, взрывчаты. Это необходимо учитывать при работе с олефинами, диенами и простыми эфирами, легко образующими П. с. при действии кислорода воздуха. Стабильность П. с. возрастает с увеличением электроотрицательности заместителей, связанных с перекисной группой, а также при переходе от первичных радикалов к вторичным и третичным.
Органические П. с. (перекиси бензоила, ацетила, ди-трет-бутила) широко используют для инициирования свободнорадикальной полимеризации (См. Полимеризация), вулканизации (См. Вулканизация) каучуков, а также таких реакций, как окисление, галогенирование, присоединение по двойным связям, теломеризация и др. П. с., особенно надкислоты, применяются в органическом синтезе как окислители, например для получения окисей олефинов (Прилежаева реакция), в текстильной промышленности - как отбеливающие вещества. П. с.- промежуточные продукты многих промышленно важных реакций, например синтеза Фенола и Ацетона окислением Кумола; они играют большую роль в процессах горения и окислительных биохимических процессах.
Б. Л. Дяткин.
Лит.: Вольнов И. И., Перекиси, надперекиси и озониды щелочных и щелочною земельных металлов, М., 1964; его же, Современные воззрения на природу неорганических перекисных соединений, "Успехи химии", 1972, т. 41, в. 4; Карножицкий В., Органические перекиси, пер. с франц., М., 1961.
Сераорганические соединения
Сераоргани́ческие соедине́ния — обширный класс химических соединений, содержащих в молекуле связь углерод — сера.
Сераорганические соединения
вещества, содержащие в молекуле связь углерод - сера. С. с. многочисленны и разнообразны; сера, наряду с водородом, кислородом, азотом и галогенами, - один из основных элементов-органогенов. В С. с. атом S может находиться в любой характерной для него степени окисления: S (-2), S (+4) и S (+6). Главные типы С. с. (R, R', Ar - органический остаток): 1) содержащие S (-2) - Меркаптаны (тиоспирты) RSH, Тиофенолы ArSH, тиоальдегиды R - CH=S и тиокетоны R - CS - R', Тиокислоты 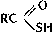 (тиоловые кислоты),
(тиоловые кислоты),  (тионовые кислоты) и
(тионовые кислоты) и 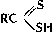 (дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты
(дитиокислоты), а также их разнообразные производные, тиоэфиры (органические Сульфиды) R - S - R', ди- и полисульфиды R - Sx - R' (x ≥ 2), соли сульфония RR'S+X - (X - анион, например Cl -; см. Ониевые соединения), серосодержащие гетероциклы, например Тиофен, а также многочисленные соединения различных классов, несущие серосодержащую группировку, например меркаптоаминокислоты; 2) С. с., содержащие S (+4), - сульфиновые кислоты 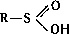 и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
и сульфоксиды RSOR'; 3) содержащие S (+6), - сульфокислоты RSO3H и сульфоны R - SO2 - R'.
Основные методы синтеза С. с. основаны на реакциях органических соединений с элементарной серой или её простейшими неорганическими соединениями:
H2S, Na2S, NaSH, SCI2, SO2, SO3, H2SO4.
Ниже приведены схемы некоторых реакций:
Ar - H + H2SO4 → ArSO3H + H2O
Большое значение имеют также методы, основанные на взаимных превращениях С. с.
К С. с. принадлежат многие важные природные вещества, например аминокислоты Цистеин и Метионин, ряд коферментов (См. Коферменты) (кофермент А, липоевая кислота), витаминов (тиамин, биотин), антибиотиков (например, Пенициллины). Сульфгидрильные группы цистеина играют важную роль в активном центре многих ферментов. Дисульфидные связи цистина, образующиеся в результате связывания двух остатков цистеина, участвуют в поддержании пространственной структуры белков (См. Белки) и пептидов. К С. с. относятся также многочисленные лекарственные и физиологически активные синтетические вещества, в том числе Сульфаниламидные препараты, Радиозащитные средства (цистамин, цистафос и др.), инсектофунгициды и ростовые вещества, отравляющие вещества (иприт), Красители различных классов - сернистые, некоторые анилиновые, антрахиноновые, фталоцианиновые. Как С. с. можно рассматривать и некоторые высокомолекулярные соединения, например Полисульфидные каучуки (тиоколы); на образовании С. с. основана Вулканизация каучуков серой (и сё производными). С. с. используются в качестве ингибиторов полимеризации и окисления, стабилизаторов полимерных материалов (меркаптобензимидазол и др.), растворителей (тетраметиленсульфон, диметилсульфоксид). Соли органических сульфокислот применяют как поверхностно-активные вещества (Моющие средства). Многие С. с., например ароматические сульфокислоты, - важные полупродукты основного органического синтеза.
Б. Л. Дяткин.
Википедия
Азотсодержащие органические соединения
Азотсодержащие органические соединения — весьма обширный класс органических соединений, в состав которых входит азот.
Азот входит в состав:
- таких природных соединений, как: аминокислоты, нуклеиновые кислоты, белки, гемоглобин, хлорофилл, гормоны, алкалоиды;
- таких искусственных соединений, как: лекарственные средства, удобрения, красители, полимеры.
Азот может входить в состав таких функциональных групп, как:
- нитрогруппа— с образованием сложных эфиров азотистой кислоты с общей формулой R-O-N=O, называемых органическими нитритами (изоамилнитрит, сосудорасширяющий и понижающий кровяное давление препарат из разряда попперсов). Изомерами органических нитритов являются нитросоединения, в которых азот нитрогруппы связан с углеродом. Нитросоединения используют в производстве красителей, лекарственных препаратов, взрывчатых веществ (тетранитрометан, нитробензол, тринитротолуол, нитронафталины);
- нитратогруппа— с образованием сложных эфиров азотной кислоты и спиртов с общей формулой R-O-NO2, называемых органическими нитратами. Применяются для производства взрывчатых и лекарственных веществ ( нитроцеллюлоза, пироксилин, пентаэритриттетранитрат, нитроглицерин, динитрат изосорбида);
- аминогруппа—с образованием первичных аминов, как производных аммиака с общей формулой R—NH2. В комбинации с карбоновыми кислотами с образованием амидов карбоновых кислот с общей формулой R—CO—NH2. В аминокислотах в комбинации с карбоксильной группой;
- R—CN (нитрилы).
Примеры употребления для Перекисные соединения
1. Это продукты неполного сгорания в виде оксида углерода, альдегиды, кетоны, водород, перекисные соединения, сажа, оксиды азота, соединения свинца и других тяжелых металлов, диоксид серы, углеводороды - в том числе канцерогенные, способствующие развитию раковых заболеваний". По словам эколога, челябинцы сейчас дышат всей таблицей Менделеева, и если ничего не изменится, через пять-семь лет количество раковых больных в городе увеличится вдвое.
